Le myélome multiple (MM) est une prolifération plasmocytaire maligne qui sécrète une immunoglobuline monoclonale ou un fragment de cette immunoglobuline (chaine légère).
En France, c’est l’hémopathie maligne la plus représentée après les lymphomes non hodgkiniens, avec 5442nouveaux cas diagnostiqués sur l’année 2018, et son incidence est en augmentation.
Le MM est plus fréquent chez l’homme avec un sex-ratio de 1,4 : 1. L’incidence du MM augmente avec l’âge, et environ 90% des cas surviennent après 50 ans. L’âge médian au diagnostic est de70 ans chez l’homme et 74 ans chez la femme.
L’histoire évolutive du MM est caractérisée par des séquences de rémission et de reprise évolutive, avec une évolution clonale caractérisée par des accumulations d’anomalies chromosomiques et moléculaires.
Le bilan initial doit comprendre dans la plupart des cas :
- NFS
- Ionogramme, créatininémie, clairance
- Calcémie, bilan hépatique, CRP
- Albuminémie, béta-2-microglobuline, LDH
- Electrophorèse des protéines plasmatiques avec immunofixation
- Chaines légères libres (CL) sériques
- Protéinurie urinaire sur miction ou sur 24h (siabsence de CL libres sériques)
- Ponction médullaire (BOM si ponction blanche)avec :
- TEP-TDM ou TDM-faible dose en 1èreintention (selon disponibilité) o Si négative ou non-concluante,IRM corps entier ou rachis/bassin o Si plasmocytome : privilégierTEP-TDM si extra-médullaire, IRM si osseux o Si suspicion de compressionmédullaire ou d’épidurite : privilégier IRM
- Bilan pré-thérapeutique (avant autogreffe de cellules souches) :
Les critères diagnostiques sont les suivants :
- Plasmocytose médullaire ≥ 10% et < 60%
Et/ou
- Taux du composant monoclonal sérique ≥ 30 g/L et/ou urinaire ≥ 1g/24h +
- Absence des critères SLiM-CRAB pouvant être attribué à la prolifération plasmocytaire
Les critères pronostiques sont les suivants (les « 20 – 20 – 20 ») :
- Composant monoclonal > 20 g/L
- Plasmocytose médullaire ≥ 20 %
- Ratio CL > 20
- +/- anomalies à haut-risque cytogénétique(del17p, t(4 ;14) ; gain 1q, hyperdiploïdie)
Signification du score :
0 facteur : faible risque (risque de progression à 2 ans de 6%, à 5 ans de16%)
1 facteur : risque intermédiaire (risque de progression à 2 ans de 32%, à 5 ans de 59%)
2 facteurs : haut risque (risque de progression à 2 ans de 69%, à 5 ans de100%)
Imagerie initiale : TDM-faible dose ou TEP-TDM (selon disponibilité)
- Si négatif IRM corps entier
- Suivi annuel si MM asymptomatique stable avec risque intermédiaire ou haut-risque
Suivi biologique : tous les 3 ou 6 mois selon le risque
Plasmocytose médullaire ≥ 10% ou infiltration plasmocytaire sur biopsie + au moins un critère CRAB ou SLiM-Crab :
- Hypercalcémie : > 2.75mmol/L ou > 0.25mmol/L à la normale haute
- Insuffisance rénale : créatininémie > 177µmol/L ou clairance < 40ml/min
- Anémie : Hb < 10g/dl ou baisse de 2 g/dl par rapport à la normale basse
- Lésions ostéolytiques
- ≥ 60% de plasmocytose
- Ratio CL ≥ 100
- > une lésion focale à l’IRM > 5 mm
Il existe deux entités de plasmocytome solitaire : osseux et extra-médullaire.
Les critères diagnostiques sont les suivants :
Facteurs associés à un risque de progression en MM plus élevé :
- Plasmocytomes solitaires osseux (65-84% à 10 ans) vs extramédullaires (25-35% à 10 ans)
- Infiltration médullaire plasmocytaire < 10% (PFS et médiane de progression de 26 mois)
- Ratio CL anormal (44% à 5 ans et 51% à 10 ans)
Imagerie :
- IRM corps entier recommandée pour les plasmocytomes solitaires osseux
- TEP-TDM à privilégier pour le bilan d’extension des plasmocytomes extra-médullaires
- Pour le suivi : tous les ans au moins pendant 5 ans (avec le même examen qu’au diagnostic)
Primaire(60-70%) ou secondaire (30-40%)
Critères diagnostiques :
Les critères diagnostiques sont les suivants :
Réponse complète stricte = sRC
- Disparition dans le sérum et les urines du composant monoclonal (confirmée par immunofixation).
- ≤ 5% de plasmocytes dans la moelle.
- Rapport sérique des chaînes légères libres (CLL) normal (rapport κ/λ normal)
- Disparition de toute lésion plasmocytaire extra osseuse
Réponse complète = RC
- Disparition dans le sérum et les urines du composant monoclonal (confirmée par immunofixation).
- ≤ 5% de plasmocytes dans la moelle.
- Disparition de toute lésion plasmocytaire extra osseuse
Très bonne réponse partielle = TBRP
- Composant monoclonal détecté seulement par immunofixation (composant monoclonal sérique absent à l’électrophorèse)
Ou ≥ 90 % de réduction du composant monoclonal sérique et composant monoclonal urinaire < à 100 mg /24h
Réponse partielle = RP
- ≥ à50 % de réduction du composant monoclonal sérique, et ≥ à 90 % de réduction du composant monoclonal urinaire (ou valeur absolue inférieure à 200 mg /24h).
- Ou ≥à 50 % de réduction du taux de CLL anormale, si myélome non excrétant
- SiCLL également non évaluable, ≥ 50% de réduction de la plasmocytose médullaire(si ≥ 30% au diagnostic) ou ≥ 50% de réduction de la taille d’un plasmocytome.
La progression est définie par la présence d’un ou plusieurs des critères suivants :
- Augmentation≥ à 25% par rapport à la valeur basale :
o du composant monoclonal sérique (augmentation en valeur absolue d’au moins 5 g/l)sur deux prélèvements.
o du composant monoclonal urinaire (augmentation en valeur absolue d’au moins 200mg/24h) sur deux prélèvements.
o du taux de CLL (augmentation en valeur absolue d’au moins 100 mg/l), chez les patients sans composant monoclonal sérique et urinaire mesurable.
o Du pourcentage de plasmocytes dans la moelle (la valeur absolue doit être ≥ 5% encas de RC ou ≥ 10% pour les autres réponses).
o De la taille d’une lésion osseuse existante, ou de la taille d’une lésion plasmocytaire extra osseuse, ou apparition d’une nouvelle lésion osseuse ou d’une nouvelle lésion plasmocytaire extra osseuse.
- Rechute clinique avec réapparition des critères CRAB
-Réapparition d’un composant monoclonal sérique ou urinaire en immunofixation ousur l’électrophorèse.
- Plasmocytose médullaire ≥ 5%.
- Tout autre signe de progression (lésion(s) osseuse(s), hypercalcémie…)
- Apparition d’une lésion plasmocytaire extra-osseuse ou de lésions osseuses,
- Augmentation de taille d’une lésion plasmocytaire extra-osseuse existante, ou des lésions osseuses,
- Hypercalcémie≥ 11,5 mg/dl ou 2,65 mmol/L,
- Diminution du taux d’hémoglobine ≥ 2 g/dl par rapport au taux de base, - Élévation de la créatinine sérique à 20mg/L ou plus (177 μmol/L).
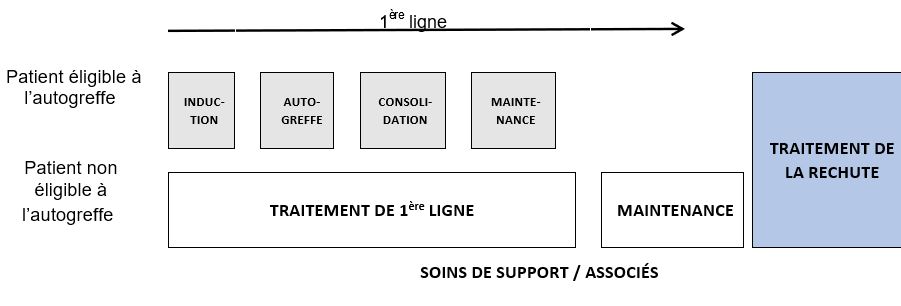
Favoriser l’inclusion dans les protocoles de recherche
Pour tout myélome symptomatique : soins de support selon les recommandations de l'IFM
Hors protocole :
- L’autogreffe reste le standard pour les patients âgés de ≤ 70 ans ne présentant pas de contre-indication
- Induction : DVRD 4 à 6 cycles de 28 jours, daratumumab classique, bortezomib hebdomadaire J1 J8 J15 et J22, lenalidomide 21j sur 28, dexamethasone hebdomadaire les jours de daratumumab
- Recueil CSH après C3, mobilisation par steady (GCSF + plerixafor)
- Consolidation : 2 cycles de DVRD si 4 cycles en induction
- Entretien : DR pendant 24 mois ou guidé par la MRD sustained (10-5, CMF, Euroflow). Poursuite jusqu’à progression pour les patients de HR cytogénétique
Pas d’indication à une double autogreffe
Cas particuliers : DKRD pour les patients très jeunes de haut risque cytogénétique à discuter, 6 cycles d’induction puis entretien
Approche prioritaire : Essais cliniques
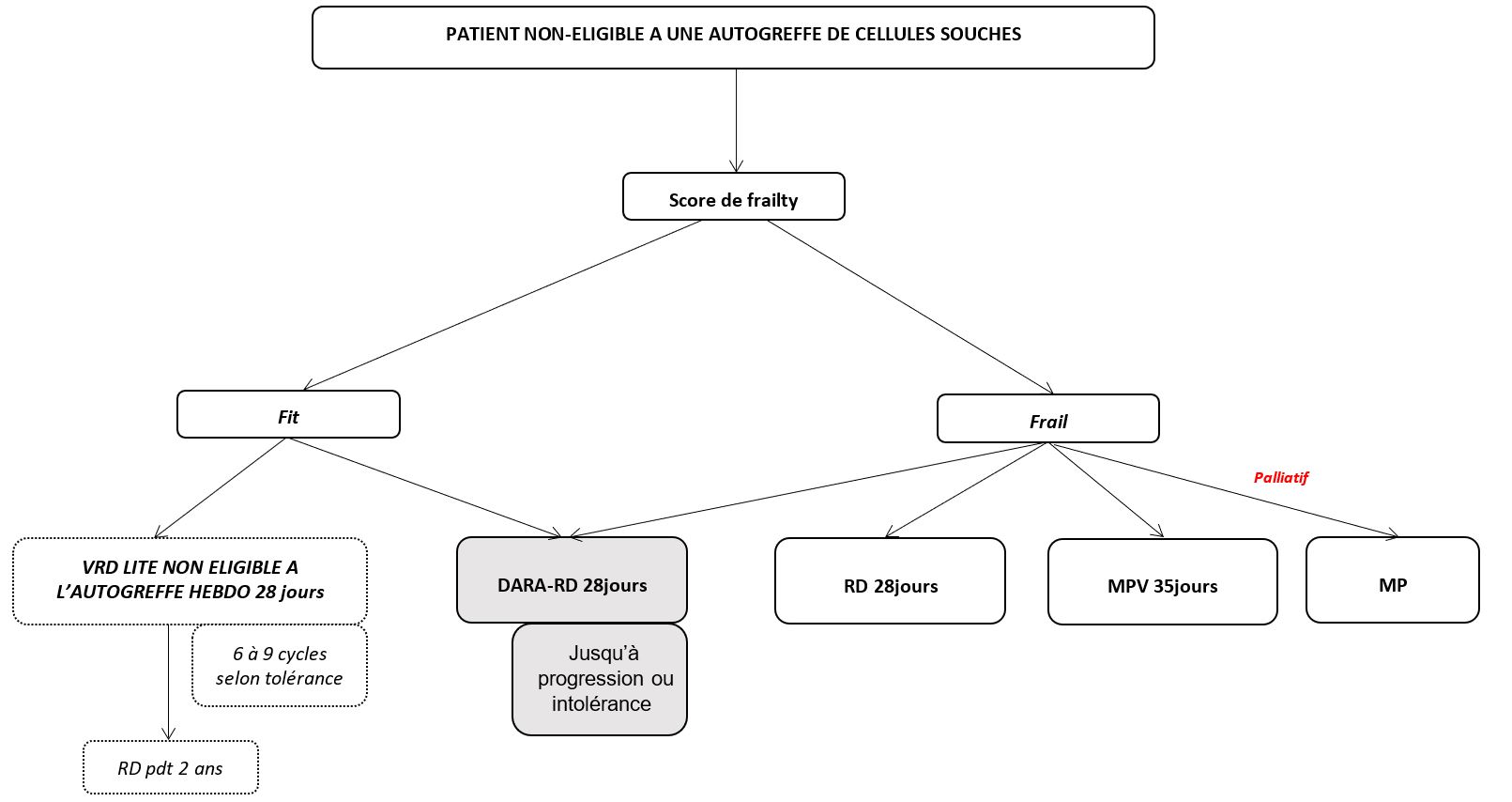
Hors protocole (cf algorithme) :
Fit :
- DaraVRD ou IsaVRD pendant 6 à 12 cycles de 28 jours selon la tolérance, avec bortezomib hebdomadaire J1 J8 J15 (pas de J22) puis poursuite DR jusqu’à progression ou intolérance
- Ou DRd jusqu’à progression ou intolérance
Frail :
- DR avec arrêt de la dex à C3
Le traitement à la rechute estguidé par plusieurs points importants :
- le caractère réfractaire ou non au lenalidomideet/ou aux anticorps monoclonaux et/ou au bortezomib
- la durée de réponse après l’autogreffe decellules souches
- la présentation clinique de la rechute(agressivité, performans status)
- Facteurs de risque cytogénétiques
Approche prioritaire : Favoriser l'inclusion dans les protocoles de recherche
Hors protocole :
Suivre les recommandations de l'ESMO-EHA
Considérations supplémentaires :
Traitement par CAR-T cells par :
- Actuellement à IDE-CEL (Abecma) dès la 3è ligne (2ème rechute)
- Bientôt à CILTA-CEL (Carvikty) à privilégier dès la première rechute si patient LENALIDOMIDE réfractaire.
- Privilégier CAR-T cells avant un traitement par anticorps bispécifique antiBCMA
1ère intention :
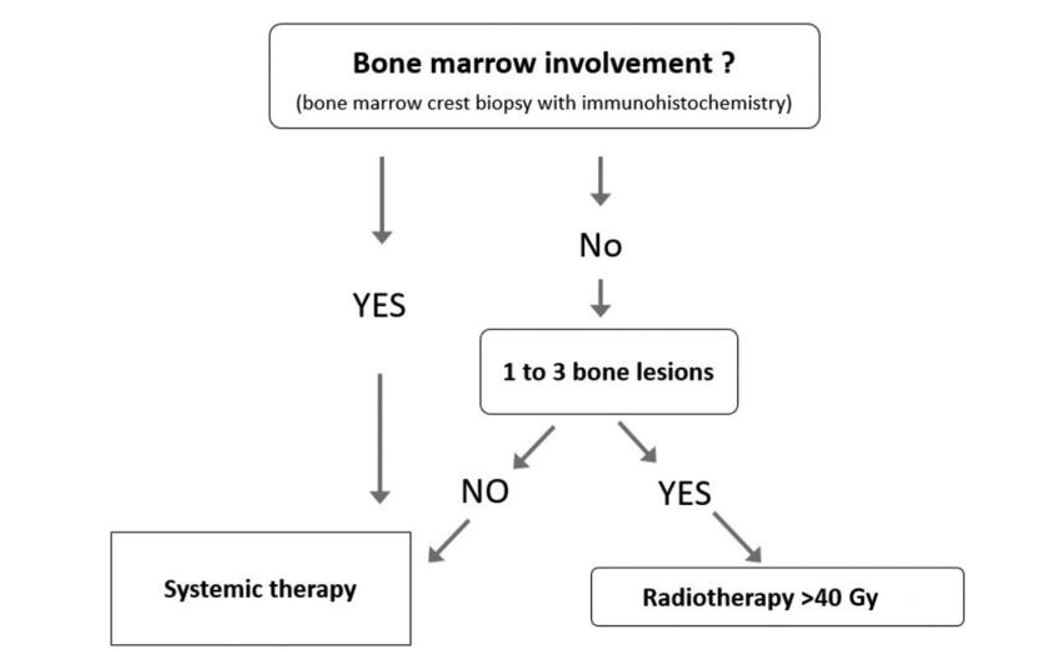
- Radiothérapie fractionnée 40-50 Gy sur 4 semaines (1.8 à 2 Gy par jour) avec une marge ≥ 2cm (Grade IA)
- Chirurgie uniquement à évoquer pour :
Les critères de réponse sont les mêmes que pour le myélome multiple + RECIST
A la rechute : traitement systémique basé sur du bortezomib (VRD, VCD) avec autogreffe de cellules souches selon éligibilité
- Voir si inclusion dans un protocole possible
Patient fit éligible à une intensification :
- Induction par DVTD x 6, autogreffe 1, autogreffe 2, consolidation DVTD 4 à 6 puis RD maintenance +/- IP
- Alternative : alternance PAD / VCD pour 4 cycles au total (J1 = J22)
Cycles 1 et 3 PAD: Bortezomib 1,3 mg/m2 SC (J1, J4, J8, J11) + Doxorubicine liposomale pégylée 30 mg/m2 IV 30 mn (J4) + Dexamethasone 40 mg per os (J1, J4, J8, J11)
Cycles 2 et 4 VCD : Bortezomib 1,3mg/m2 SC (J1, J4, J8, J11) + Cyclophosphamide 300 mg/m2per os (J1, J8) + Dexamethasone 40 mg per os (J1, J4, J8, J11)
o Collecte de cellules souches périphériques (CSP) d’une hyperhydratation + G-CSF après les 4 cycles si ≥ maladie stable et plasmocytes circulants < 1%
o Autogreffe n°1 (dans le mois suivant le recueil de CSP) : avec un conditionnement par Melphalan
200 mg/m2
o Le deuxième traitement intensif doit être réalisé à 3 mois de l’auto n°1 : Autogreffe n° 2 o Consolidation / maintenance (dans les 3 mois post auto n°2)
Pour les patients non éligibles
- DRD et maintenance ou VD
traitement du myélome multiple
PS : translocation t(11 ;14) dans ≥50% des cas donc possible intérêt du VENETOCLAX
Si localisé : radiothérapie (réponse souvent lente à apparaître, dans les 3 à 6 mois)
Si disséminé :
- Si fit et maladie proliférante ou avancée à RD(2 cycles 25mg J21/J28, Dex hebdo) puis autogreffe conditionnée par melphalan200
- RD 9 cycles 25mg J21/J28, Dex hebdo puis 12cycles à R 10mg 28j/28j - Si frail :MP
VCD en deuxième ligne
- Valaciclovir si inhibiteur du protéasome ou anticorps monoclonal
- Anti-pneumocystose si dexamethasone et sihypogammaglobulinémie profonde (< 6g/L) (pour les 6 premiers mois aumoins)
- Levofloxacine chez les patients éligibles à uneautogreffe de cellules souches lors des 3 premiers mois (500mg/jour) OUAmoxicilline 1g x 2/j
Vaccination :
Il est recommandé de vacciner avantde débuter le traitement :
- Pneumocoque : Prevenar13 puis Pneumo23 ≥ 2 moisaprès
- Haemophilusinfluenza
- Grippe saisonnière pour le patient et sonentourage
- Vaccination contre le zona
Prophylaxie anti-thromboembolique veineuse :
Possibilité de calculer l’IMPEDE-VTE score
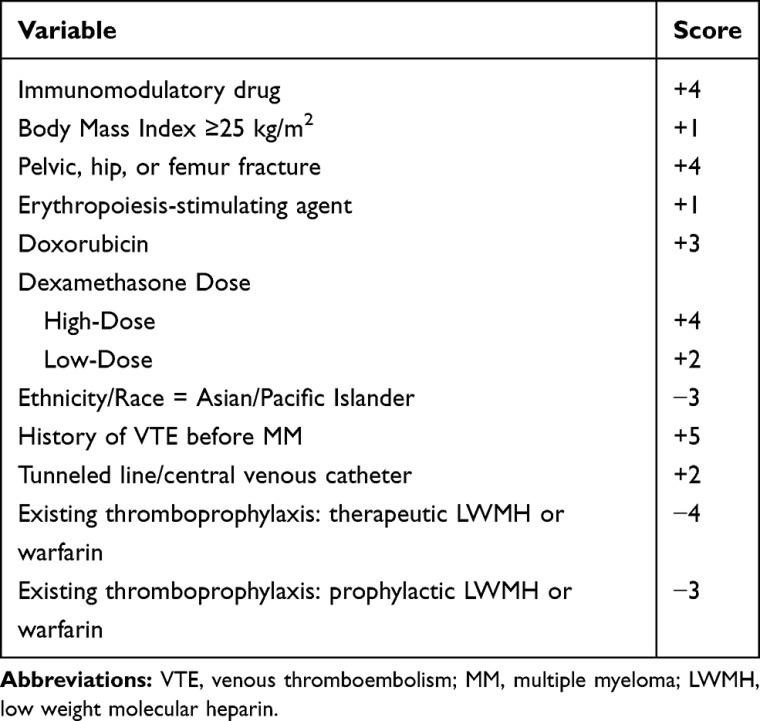
- Si < 4 : aspirine 100 mg
- Si entre 4 et 7 : HBPM préventive (lovenox 0.4ml) par jour pendant 6 mois puis relais par aspirine 100mg - Si ≥ 8 : HBPM dose curative (Innohep 175UI/kg)
Préventionde la maladie osseuse :
- Prescription de biphosphonates après bilandentaire pour tout patient débutant un traitement quelque soit le biland’imagerie et la présence de lésion lytique
- Durée et fréquence : une fois par mois, pendant2 ans si RC, à continuer si RP
- Possibilité de le faire à domicile, ZOMETA® 4mgsur 15min (si clairance normale) avec CACIT D3
- Ou ACLASTA® 90mg sur 4h (plutôt àl’hôpital)
Liés aux anticorps monoclonaux anti-CD38
- Prélever groupe sanguin et RAI avant de débuterun traitement par anticorps monoclonal anti-CD38
- RAI positive sous traitement et au moins 6 moisaprès l’arrêt
- Prévenir l’EFS que le patient est traité paranticorps monoclonal anti-CD38
- Peut être détecté sur l’EPP et l’immunofixationet ainsi perturber l’évaluation de la réponse