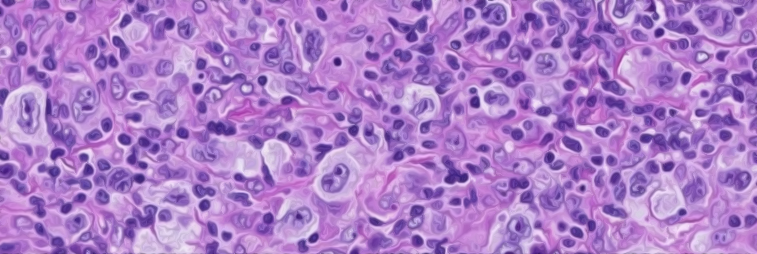
· Examen histologique standard avec classification exprimée selon la classification OMS.
· Nécessité de congeler une partie du prélèvement pour examen immunohistochimique. Les cellules de Sternberg sont EMA -, CD30+,CD15+
· Préférer de biopsier les adénopathies cervicales et axillaires plutôt que les adénopathies inguinales
Lymphomes hodgkiniens nodulaire à prédominance lymphocytaire (dit lymphome de Poppema) : CD45+, CD19+, CD20+, CD22+, CD79a+, CD15-, CD30-/+, EMA+/-, R-Ig-, R-TCR-, EBV-
Lymphomes hodgkiniens classiques
Référence : classification OMS 2022
o Examen clinique complet
o Imagerie diagnostique
- Scanner thoracique (mesure de la masse médiastinale)
- Scanner abdomino-pelvien
- TEP-TDM avec le 18F-FDG indispensable pour le staging initial, l’évaluation de la masse tumorale en début de traitement.
o Biologie
- NFS, VS, LDH, ß2 microglobuline, CRP
- Bilan biologique hépatique complet, phosphatases alcalines
- Bilan martial : ferritinémie + CST (coefficient de saturation de la transferrine)
- Electrophorèse des protéines, fibrinémie, fer sérique
- Sérologie HIV, hépatite B, hépatite C
o Biopsie ostéomédullaire non nécessaire si l’évaluation est faite par le TEP scanner 1
o Echocardiographie, EFR
o Conservation de sperme pour malades jeunes
o Options
- IRM
- Scintigraphie osseuse
- Tout autre examen jugé nécessaire pour préciser l’extension de la maladie
CLASSIFICATIOND’ANN ARBOR en tenant compte des modifications selon Revised staging Systemfor primary Nodal lymphomas 1
Atteintenodale* : l’amygdale, l’anneau Waldeyer et la rate sont considérés commeun tissu nodal
Bulky** :masse tumorale volumineuse définie par masse >10cm ou >1/3 de diamètrethoracique au niveau vertèbre thoracique sur TDM
A : Absence desymptômes systémiques
B : Fièvre,sueurs nocturnes ou perte de poidsinexpliquée de > 10% dans les six derniers mois.
Le classement enstades selon la classification d’Ann Arbor modifiée selon Costwolds complétépar l’évaluation des facteurs pronostiques permet de définir des groupesthérapeutiques.
EORTC/GELA
A) Masseganglionnaire volumineuse (≥ 10 cm ou rapport MT ≥ 0.35)
B) Age ≥ 50 ans
C) VS > 50 mm/hsans symptomes B ou VS > 30 mm/h avec symptomes B
D) ≥ 4 territoiresganglionnaires
GHSG
A) Massemédiastinale volumineuse (MT ≥ 0.35)
B) Atteinteextranodale
C) VS > 50 mm/hsans symptômes B ou VS > 30 mm/h avec symptômes B
D) ≥ 3 territoiresganglionnaires
EORTC, EuropeanOrganisation for research and Treatment Cancer; GELA, Groupe d’Etude desLymphomes de l’adulte; GHSG, German Hodgkin Study Group
Score IPS (The InternationalPrognostic Factors Project Score)
Albumine sérique< 40 g/l
Hémoglobine <105 g/l
Sexe masculin
Stade IV
Age ≥ 45 ans
Leucocytes ≥ 15 x109 /l
Lymphocytes <0,6 x 109/l
Chaque facteurpronostique associé aux stades avancés réduit la survie de 7 à 8 % par année.
4 variables :
Age : <40ans (= 0), ≥40 ans (= 1)
Territoireslymphoïdes : 1-2 (= 0), 3-4 (= 1), ≥5 (= 2)
Viscères noncontigus : non (= 0), ≥1 (= 1)
Symptômes généraux :absents (= 0), présents (= 1)
Groupe favorable :Score 0 ou 1
Groupeintermédiaire : Score 2 ou 3
Groupedéfavorable : Score 4 ou 5
Le traitement depremière intention adopté dépend du stade et des facteurs de risqueprésents (en considérant qu’il existe deux scores majoritairementutilisés) : stade localisé favorable, stade localisé défavorable et stadeavancé.
EORTC /GELA
GHSG
Stade localisé favorable
Std. I-II sans facteur risque
Std. I-II sans facteur de risque
Stade localisé défavorable/
Std. I-II ≥ 1 facteur risque
Std.I ≥ 1 facteur risque
Intermédiaire
Std. IIA ≥ 1 facteur risque
Std. IIB avec facteur risque C/D
Stade avancé
Std.III-IV
Std. IIB avec facteur risque A/B
Std.III-IV
L’évaluationau début du traitement
ÞEchographie cardiaque et EFR
ÞCECOS et cryopréservation du tissu ovarien (si possible)
Les stratégies thérapeutiques dans les stades localisés
La combinaison dechimio-radiothérapie est nécessaire à la fois pour les stades localisésfavorables et défavorables après l’analyse du protocole H10.6L’évaluation de la réponse précoce parle TEP scanner après la deuxième cure est prédictive sur l’évolution dulymphome de Hodgkin. 7Dans l’étude de Gallamini et al, les scores 1 à 3 selon les critèresde Deauville sont considérés comme négatifs et les scores 4 et 5 sontconsidérés comme positifs.7Dans le protocole H10, TEP après deux cure ABVD est considérée négative pourles scores 1 et 2 selon les critères de Deauville puisque le protocoleenvisageait une désescalade de traitement par omission de radiothérapie chezles répondeurs métaboliques précoces.6
1.1.1. Favorables :
1.1.1.1. Standard :
- Absence de facteurs de risque del’EORTC/GELA : 3 cycles ABVD suivis de l’irradiation des airesganglionnaires initialement atteintes à 30 Gy
- Absence de facteurs de risque du GSHG :2 cycles ABVD + 20 Gy.
Argumentation :l’essai allemand récent (HD10) semble montrer que pour les stades I ou II sansfacteurs de risques il n’y a pas de différence pour les taux de réponse,progression et rechute entre les 4 groupes : 4 ABVD + 20 Gy ; 4 ABVD+ 30 Gy ; 2 ABVD + 20 Gy ; 2 ABVD + 30 Gy). Dans cet essai il n’ypas l’évaluation intermédiaire par TEP8.
1.1.2. L’évaluation par TEP-TDM avec le 18F-FDG :
Il estnécessaire d’évaluer la masse résiduelle après chimiothérapie et avant RTE parTEP-TDM avec le 18F-FDG.
Le délai RTE-TEPest plutôt de 8 à 12 semaines afin d’éviter les réactions inflammatoirespost-RTE surtout au niveau thoracique (risque de faux positifs). La comparaisondes images avant et après RTE est indispensable pour déterminer une RC. Desacquisitions tardives de 2 h à 2 h 30 post-injection du FDG de la TEP-TDMseront proposées en fonction des images obtenues
1 heure après injection du FDG.
Þ sipas RC, on identifie les vraisréfractaires primaires
Þ siRC, surveillance avec Scanner cervico thoraco pelvien tous les 6 mois pendant 2ans, ensuite tous les ans
Argumentation :
1) Il a été montré que la plupart des malades en formeslocalisés avec TEP positif après 2 cures est restée en rémission dans les 2 ansde suivi. Par contre, tous les malades de stades avancés avec unTEP positif après 2 cures ont rechuté dans les 2 ans de suivi 10.
Standard :
- plus d’un critère de l’EORTC/GELA : 4cycles ABVD suivie de l’irradiation des aires ganglionnaires initialementatteintes à 30 Gy
- plus d’un critère du GHSG : 2 BEACOPPescaladé + 2 ABVD, suivies de 30Gy.
Argumentation : L’essai allemand GHSG HD 14 a comparé 4 cycles ABVD à 2BEACOPP escaladé + 2 ABVD, suivies de30Gy IF RT, avec une augmentation de 6% de PFS dans le bras BEACOPP escaladé +2 ABVD. Dans cet essai l’évaluation tumorale par TEP n’a pas été réalisée.
Standard : TEP-TDMavec le 18F-FDG après 4 cures, avant la radiothérapie
Attention :étant donné que les formes avec IMT > 0.33 ou atteinte extraganglionnairesont considérées comme des formes disséminées (recommandations INCa), l’option6 AVBD + RT 30 Gy est supprimée.
Standard :
Ä Chez les sujets jeunes : 6 BEACOPPescaladé ou 8 ABVD. Pour les femmes jeunes, prévoir unediscussion avec la patiente et le Centre de Biologie de la Reproduction du faitdu risque d’hypofertilité
Argumentation : Après un suivid’environ 10 ans, dans l’étude GHSG HD9 de stade avancé, le régime BEACOPPescaladé permet d’obtenir la survie globale à 86 % et survie sans échec à 82 %.11
L’étude italienne amontré la supériorité du protocole BEACOPP en terme de survie sans progressionpar rapport à l’ABVD (81 % contre 68%) 13
Désescalade ?
Ä Chez les sujets de plus de 60 ans, 8 ABVD
Options :
1) 8ABVD en cas de contre-indication au BEACOPP. Une irradiation des zonesinitialement
atteintes peut être indiquée dans les cas suivants :
- rémissionpartielle
- bulky initial
- si l’étatclinique ne permet pas de faire 8 cycles ABVD.
EFR régulières(tous les 2 ABVD) + Echographie cardiaque tous les 4 ABVD
Argumentation : Malgré une supériorité du régime BEACOPP en terme de surviesans progression par rapport à l’ABVD, le régime BEACOPP a été responsable d’un grand nombre de cas de neutropénie de grade 3et 4 (54 % contre 34%) et d’infections (14 % contre 2 %).
Dans l’étuded’Aleman et al., pour les maladesen rémission partielle, la radiothérapie de consolidation a apporté un bénéficeréel alors qu’il n’a pas été observé chez les malades en rémission complète 15.
Chez les sujetsjeunes :
après 4 curesBEACOPP escaladé
Þ siTEP positif : réfractaire primaire et rattrapage + double autogreffe ou auto /allogreffe
Þ siTEP négatif, 2 cures supplémentaires de BEACOPP escaladé
Chez les sujets nonintensifiables
TEP après 4 ABVDchez les patients chez qui 8 ABVD ont été proposés
L’évaluation de la fonction cardiaque et pulmonaire
ÞEchographie cardiaque et EFR au début du traitement et après 4 cures de BEACOPPescaladé
La réalisation deBOM en cas de cytopénie est recommandée pour le diagnostic du syndromed’activation macrophagique. La chimiothérapie par ABVD est privilégiée pouréviter les toxicités secondaires au régime de BEACOPP escaladé. En dehors de laprophylaxie contre la pneumocystose et le virus varicelle-zona, en cas d’untaux de CD4<100/mm3, la prophylaxie contre candida albicans par fluconazole 200 mg/j et contre la mycobactérieatypique par azithromycine 1200mg/j est fortement conseillée. Il fautsurveiller les interactions médicamenteuses des antiviraux, notamment il estproscrit l’usage de ritonavir qui augmente fortement la toxicité neurologiqueet hématologique (neutropénie) de vinblastine17
Le risque demalformation est majeur entre la 2ème semaine et la 8èmesemaine après la conception. L’imagerie par le scanner ou TEP et l’IRM n’estpas applicable. Pour le traitement, certains cas rapportés montrent lafaisabilité du régime ABVD pour le 2ème et 3èmetrimestre. La bléomycine doit être évitée lorsque la date de délivrance estproche. La radiothérapie sus diaphragmatique dans les cas localisés peut êtreréaliée pour le 2ème et 3ème trimestre. L’ondansetron etmetoclopramide peuvent être administrés comme traitement anti-émétique. L’usagede G-CSF et les antibiotiques type pénicilline et céphalosporine est sansconséquence.18
Du fait ducaractère très rare de cette forme histologique, le LH nodulaire à prédominancelymphocytaire (ou paragranulome dePoppema) est pris en charge à partir d’un accord d’experts.
Au stade IA sansfacteurs de risque, une exérèse chirurgicale seule du ganglion, si elle estcomplète, avec une surveillance clinique peut suffire. Cette chirurgie peutêtre associée en cas d’exérèse incomplète à une radiothérapie localisée de 30Gy.
Les autres stadeslocalisés sans atteinte médiastinale peuvent être laissés en abstentioninitiale et surveillance régulière ou traités par une irradiation localiséeintranodale à 30 Gy.
Pour les stadeslocalisés avec atteinte médiastinale ou sous diaphragmatiques, sans facteur derisque mais nécessitant un traitement, une chimiothérapie brève (ABVD 2 à 3cycles) associée au Rituximab (4 cures) sans radiothérapie obligatoire declôture est une option thérapeutique.
Chez les patientsprésentant un stade disséminé, la recherche d’une évolution vers une forme plusagressive avec une possible transformation en lymphome de haut grade doit êtresystématique.
La chimiothérapieest le plus souvent de type ABVD (6 à 8 cycles) associée au Rituximab
(Optionthérapeutique).
Réfractaireprimaires Þréponse < 50 % après 4 à 6 cycles de chimiothérapie à la based’anthracyclines ou
Þprogression pendant le traitement d’induction ou
Þprogression dans les 90 jours après la fin du traitement.
Facteurspronostiques de la rechute
- Délai de rechute < 1 an
- Rechute dans un site irradié
- Hb < 105 g/L
- Symptômes B
- Stade III-IV
19, 20
Protocoles dechimiothérapie de rattrapage :
à la base de selsde platine (DHAP, ESHAP, PDG) ou à la base d’étoposide /ifosfamide (MINE,ICE, IVA, GDP, IGEV) ou brentuximab vedotin. Il n’y a pas le « goldstandard » pour la chimiothérapie de rattrapage. Le meilleur régimedoit avoir la meilleure efficacité, le meilleur recueil CSP et la moindretoxicité.
Le taux de réponseglobale (réponse complète et réponse partielle > 50 %) varie entre 54 % et88 %
(88 % pour ICE avec 26 % RC ; 88 %pour DHAP avec 21 % RC ; 76 % pourMINE ; 69 % pour PDG avec 17 % RC ; 54 % pour CEP).
Proposition :
· Sansfacteur de risque : ICE 3C si rechute post ABVD et DHAC ou DHAOx si rechutepost BEACOPP et collecte puis autogreffe conditionnée par BEAM.
· Avec 1seul ou plusieurs facteurs de risques : BENDAMUSTINE-BRENTUXIMAB (C1 sansBENDAMUSTINE pour collecte de CSP après C1) puis intensification avec 1 seuleautogreffe (conditionnement BEAM) suivie d’une maintenance par BRENTUXIMAB oudouble autogreffe.
L’évaluation parTEP-TDM avec le 18F-FDG :
Après 2èmecure de rattrapage, et le régime sera changé s’il y a une réponse partielle< 50%.
STANDARD :
1) Si au moinsun facteur de risque :
Chimiothérapiede rattrapage (3 cycles) +autogreffe
Recueil decellules souches après 2ème ou 3ème cycle
TEP-FDG après 2cycles :
- TEP négatif Þ autogreffe et IFRT après autogreffe
- TEP positif Þ 2ème lignée de rattrapage Þsi au moins PR > 50 %, double autogreffe ou auto /allo
Þ sipas RP, essai clinique
2) Si au moins 2facteurs de risque : rechute < 1 an
Rechute dans unezone irradiée
Stade III /IV
Si réfractaires primaire ou
Si non in RC après 1èreautogreffe
Chimiothérapiede rattrapage (3 cycles avec un TEP après 2ème cycle) et double autogreffeou autogreffe/allogreffe
Avant 1èreautogreffe il faut avoir RP > 50%.
Le délai entre lesdeux greffes : 45 à 90 jours.
Les régimes deconditionnement pour double autogreffe :
- 1èrerégime : BEAM 200
- 2èmerégime : BAM
Radiothérapie à 20-36 Gy après 2ème autogreffe, dès que les plaquettes > 50 G/l
3) Si rechutetardive (> 5 ans), stade localisé et sans autres facteurs depronostiques :
chimiothérapiestandard (ex : BEACOPP standard ou ABVD) et radiothérapie IFRT
4) Si rechutepost autogreffe < 5 ans :
- rattrapage cf. ci dessus
- Brentuximab
- discuter ALLOGREFFE
5) Essaiscliniques :
- Observatoire des lymphomes hodgkiniens enrechute et/ou réfractaires (envoyer les CR d’hospitalisation à Pauline BRICE,Hôpital St Louis, tous les centres peuvent être investigateurs)
ProtocoleREVOLUMHOD– : pembrolizumab ou nivolumab en monothérapie chez les patientsen rechute ou réfractaires
Þ Pasde suivi par TEP-TDM avec le 18F-FDG
ÞSuivi par Scanner cervico-thoraco-abdomino pelvien tous les 6 mois pendant 2ans; ensuite tous les ans jusqu’a 5 ans
ÞAprès cinq ans la surveillance est orientée pour la recherche d’une toxicitécardiaque (Echographie avec mesure de la fonction ventriculaire gauche),thyroïdienne après irradiation cervicale (TSH), ou gonadique.
ÞMammographie chez la femme après irradiation médiastinale ou axillaire.